تولید
اسید نیتریک با واکنش دی اکسید نیتروژن (NO2) با آب ساخته شده است.
4 NO2 + 2 H2O → 2 HNO3 + NO + NO2 + H2O
واکنش خالص است:
3 NO2 + H2O → 2 HNO3 + NO
به طور معمول ، اکسید نیتریک تولید شده توسط واکنش توسط اکسیژن در هوا به تولید دی اکسید نیتروژن اضافی reoxidized.
متلاطم دی اکسید نیتروژن از طریق پراکسید هیدروژن می تواند کمک به بهبود عملکرد اسید.
2 NO2 + H2O2 → 2 HNO3
راه حل های اسید نیتریک درجه تجاری معمولا بین 52 ٪ و 68 ٪ اسید نیتریک است. تولید اسید نیتریک از طریق فرایند استوالد است که به نام شیمیدان آلمانی ویلهلم استوالد نامگذاری شده است. در این فرآیند ، آمونیاک بی آب به اکسید نیتریک ، در حضور کاتالیزور پلاتین یا رودیوم گاز در دمای بالا حدود 500 K و فشار 9 atm اکسید می شود.
4 NH3 (g) + 5 O2 (g) → 4 NO (g) + 6 H2O (g) (ΔH = -905.2 kJ/mol)
اکسید نیتریک سپس با اکسیژن در هوا به شکل دی اکسید نیتروژن واکنش نشان داد.
2 NO (g) + O2 (g) → 2 NO2 (g) (ΔH = -114 kJ/mol)
این پس از آن در آب به شکل اسید نیتریک و اکسید نیتریک جذب می شود.
3 NO2 (g) + H2O (l) → 2 hno3 (aq) + NO (g) (ΔH = -117 kJ/mol)
اکسید نیتریک برای اکسیداسیون دوباره چرخه می شود. متناوبا ، اگر آخرین مرحله در هوا انجام شود:
4 NO2 (g) + O2 (g) + 2 H2O (l) → 4 HNO3 (aq)
Hno3 آبی به دست آمده را می توان با تقطیر تا حدود 68 ٪ توسط جرم متمرکز شده است. غلظت بیشتر به 98٪ را می توان با کم آبی بدن با H2SO4 متمرکز به دست آورد. با استفاده از آمونیاک به دست آمده از فرآیند هابر ، محصول نهایی را می توان از نیتروژن ، هیدروژن و اکسیژن که از هوا و گاز طبیعی به عنوان مواد خام تنها مشتق شده تولید می شود.
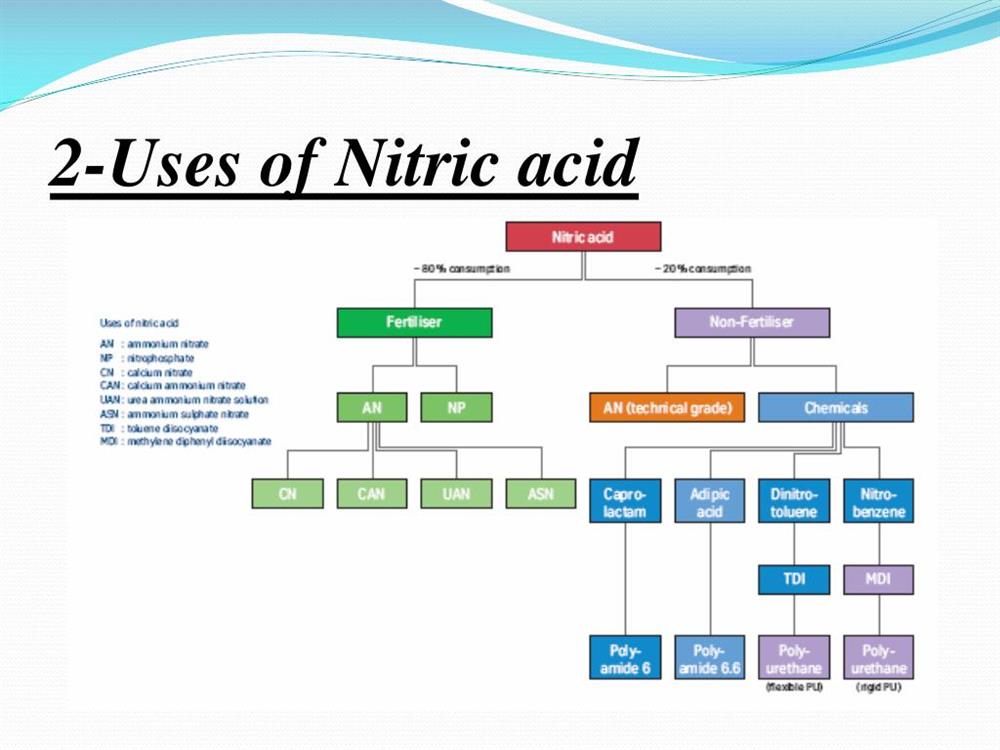
خواص اسید نیتریک را در لینک زیر بخوانید
https://bismoot.com/blog/%d8%a7%d8%b3%db%8c%d8%af-%d9%86%db%8c%d8%aa%d8%b1%db%8c%da%a9/
سنتز آزمایشگاهی
در آزمایشگاه اسید نیتریک می تواند توسط تجزیه حرارتی مس(II) نیترات تولید دی اکسید نیتروژن و گازهای اکسیژن هستند که پس از تصویب از طریق آب به اسید نیتریک.
2 Cu(NO3)2 → 2 CuO + 4 NO2 + O2
سپس ، پس از فرایند Ostwald:
2 خیر
2 + ساعت
2O → HNO
2 + HNO
3
متناوبا, واکنش برابر مول از هر نیترات نمک مانند نیترات سدیم با اسید سولفوریک (H2SO4) و تقطیر این مخلوط را در اسید نیتریک را به نقطه جوش 83 °C. A ازاین مانده از فلز هیدروژن سولفات باقی مانده در تقطیر رگ. اسید نیتریک نیتریک قرمز به دست آمده ممکن است به اسید نیتریک سفید تبدیل شود.
NANO3 + H2SO4 → HNO3 + NaHSO4
این ماده محلول به راحتی با استفاده از کاهش فشار در دمای اتاق (10-30 دقیقه در 200 mmHg یا 27 kPa) حذف می شود تا اسید نیتریک سفید سفید شود. این روش همچنین می تواند تحت کاهش فشار و دما در یک مرحله به منظور تولید گاز دی اکسید نیتروژن کمتر انجام شود.
اسید نیتریک رقیق شده ممکن است با تقطیر تا 68 ٪ اسید متمرکز شود ، که حداکثر آزئوتروپ جوش است. در آزمایشگاه ، غلظت بیشتر شامل تقطیر با اسید سولفوریک یا نیترات منیزیم است که به عنوان عوامل تخلیه کننده عمل می کند. چنین تقطیر هایی باید با دستگاه تمام شیشه ای در کاهش فشار انجام شود تا از تجزیه اسید جلوگیری شود. به طور صنعتی ، اسید نیتریک بسیار متمرکز با حل کردن دی اکسید نیتروژن اضافی در 68 ٪ اسید نیتریک در یک برج جذب تولید می شود. اکسیدهای نیتروژن محلول هستند یا در مورد سفید کالایی اسید نیتریک محروم ، و یا در راه حل باقی می ماند به شکل اسید نیتریک کالایی قرمز. اخیرا ، ابزار الکتروشیمیایی برای تولید اسید بی آب از اسید نیتریک متمرکز شده است.
منبع